Miquel Vila-Perelló: "Fa uns anys, quan parlaves amb inversors internacionals i els deies que venies de Barcelona, et miraven malament"
Cofundador i conseller delegat de SpliceBio


BarcelonaSpliceBio s'ha convertit en la companyia biotecnològica que ha captat més diners en la història del sector de tot Espanya. Des dels seus laboratoris en el Parc Científic de Barcelona (PCB), l'empresa catalana ha aixecat 119 milions d'euros en una ronda de finançament que destinarà a validar la teràpia gènica que ha desenvolupat per a una malaltia minoritària que provoca ceguesa. Fa més de deu anys, l'empresa va néixer de la investigació que van fer Miquel Vila-Perelló i Sílvia Frutos als Estats Units, sota el lideratge del professor Tom Muir, pioner en la modificació de proteïnes que els permet atacar la malaltia de Stargardt. Amb una plantilla de més de 40 treballadors, la companyia ha crescut alhora que creixia el sector biotecnològic local, que ha marcat un altre rècord d'inversió aquest primer semestre amb 227 milions d'euros, segons dades de Biocat.
Llicenciat i doctorat en química orgànica per la Universitat de Barcelona (UB), Vila-Perelló (Barcelona, 1977) va aterrar als Estats Units l'any 2005. Primer a Nova York, a la Rockefeller University, on va entrar en el grup de recerca de Muir. Després va tocar anar cap a Princeton. Va acabar passant deu anys de la seva vida a l'altra banda de l'oceà, on hi ha molts més recursos per a empreses com la seva, però l'any 2014 va voler tornar a casa per contribuir a un sector biotecnològic que estava començant a arrencar posant en marxa SpliceBio, primer batejada com a ProteoDesign.
Com porten la responsabilitat d'haver tancat la ronda més alta de la història del sector a l'Estat?
— Esperem que n'hi hagi més. Rondes com aquesta demostren als inversors internacionals que fer això a Barcelona és possible. No es tracta només dels diners que aconsegueixes, sinó del grup d'inversors que atreus. En el nostre cas, hi ha els fons de capital risc de farmacèutiques com Roche, Sanofi, Novartis i UCB, però també EQT, un dels fons més grans d'Europa, i New Enterprise Associates (NEA), un dels més grans dels Estats Units. El fet que firmes com aquestes decideixin invertir en una empresa barcelonina formada amb talent local ens ha de treure complexos, perquè ens demostra que això des d'aquí es pot fer. Fa uns anys, quan anaves a parlar amb inversors internacionals i els deies que venies de Barcelona, et miraven malament.
I ara?
— Una mica menys. La ciutat està començant a posicionar-se en el mapa, però encara queda camí. Molts d'aquests inversors internacionals desconeixen el sistema legal espanyol. És una mica diferent de com funcionen els països anglosaxons i hi ha coses que els xoquen una mica. Als inversors, tot el que no coneixen els fa por, i el millor que es pot fer davant de la por és dir no. A tots aquests inversors que ara han invertit en SpliceBio, el pròxim cop que hagin d'invertir en una altra empresa catalana o espanyola els serà molt més fàcil, perquè hi ha alguns problemes que ja els han resolt amb nosaltres. Com també va passar quan van invertir en altres biotecnològiques com Minoryx o Sanifit. Com més vegades passi, menys hi haurà aquesta barrera. En aquest sentit, Ysios Capital ha estat fent una gran feina de participar en rondes internacionals, i Asabys Partners també l'ha continuat. Això els ha permès entrar en contacte amb aquests inversors estrangers i ha facilitat que després vinguin aquí.
Què li falta a la ciutat?
— Cal que es completi el cercle. Ara tenim la idea, la inversió i el creixement de l'empresa. El sector biotecnològic ha pogut desenvolupar-se aquí per la ciència de qualitat que surt dels centres d'investigació, el creixement del capital risc a Barcelona i per l'esperit emprenedor. Però, en el cas de les companyies finançades per capital risc, els inversors han de recuperar els diners. Desenvolupar fàrmacs costa molts diners i té un risc molt elevat. Fan falta compres. Tenim exemples com quan es va adquirir la barcelonina Stat-Dx, però calen més exemples com aquest. També ens cal que fàrmacs desenvolupats aquí arribin també al mercat. Avizorex Pharma ho ha aconseguit. Però una flor no fa estiu, en calen més. Cal incentivar els inversors perquè vegin que apostar per empreses d'aquí surt a compte, però també perquè la gent jove vegi que aquí hi ha carreres de futur. Ara costa atreure talent perquè si te'n vas a treballar a una start-up de Londres o a Boston i tanca, en tens cinquanta més allà per trobar una nova feina.
I com se soluciona això?
— Amb una mica de paciència. Desenvolupar un fàrmac porta molt de temps. De mitjana, uns deu anys. I les probabilitats d'èxit són del 10%. Aquí el sector va començar a arrencar el 2014, i estem arribant al moment en què aquestes coses haurien de passar. Per tant, cal massa crítica. D'empreses biotecnològiques se n'han d'anar creant més perquè d'aquí un temps alguna aconsegueixi arribar al mercat. També calen inversors que tinguin la paciència per esperar i que vegin els fruits d'aquestes inversions. El sector de salut té un objectiu molt lloable, desenvolupar fàrmacs per millorar la vida de les persones, però els inversors inverteixen diners a risc i és raonable que esperin un retorn econòmic.
La ciutat sedueix ara grans companyies com AstraZeneca.
— Inversions com el nou centre de la farmacèutica ajuden a posicionar Barcelona en el mapa. Sanofi també té previst augmentar la seva presència a la ciutat. Tot això contribueix a captar més talent. Els polítics sovint parlen de com és d'important aquest sector, però potser no es fan gaires coses, i crec que aquest tipus d'apostes són les que fan que el sector es valori. Que la gent vegi que aquí hi ha la possibilitat de guanyar-se bé la vida en sectors que contribueixen a la societat, i que no només et pots guanyar bé la vida sent un influencer. Hauria sigut fantàstic que l'Agència Europea de Medicaments (EMA) s'hagués instal·lat a Barcelona. En absència d'això, que vingui AstraZeneca i tothom que vulgui.
Què ha aconseguit SpliceBio?
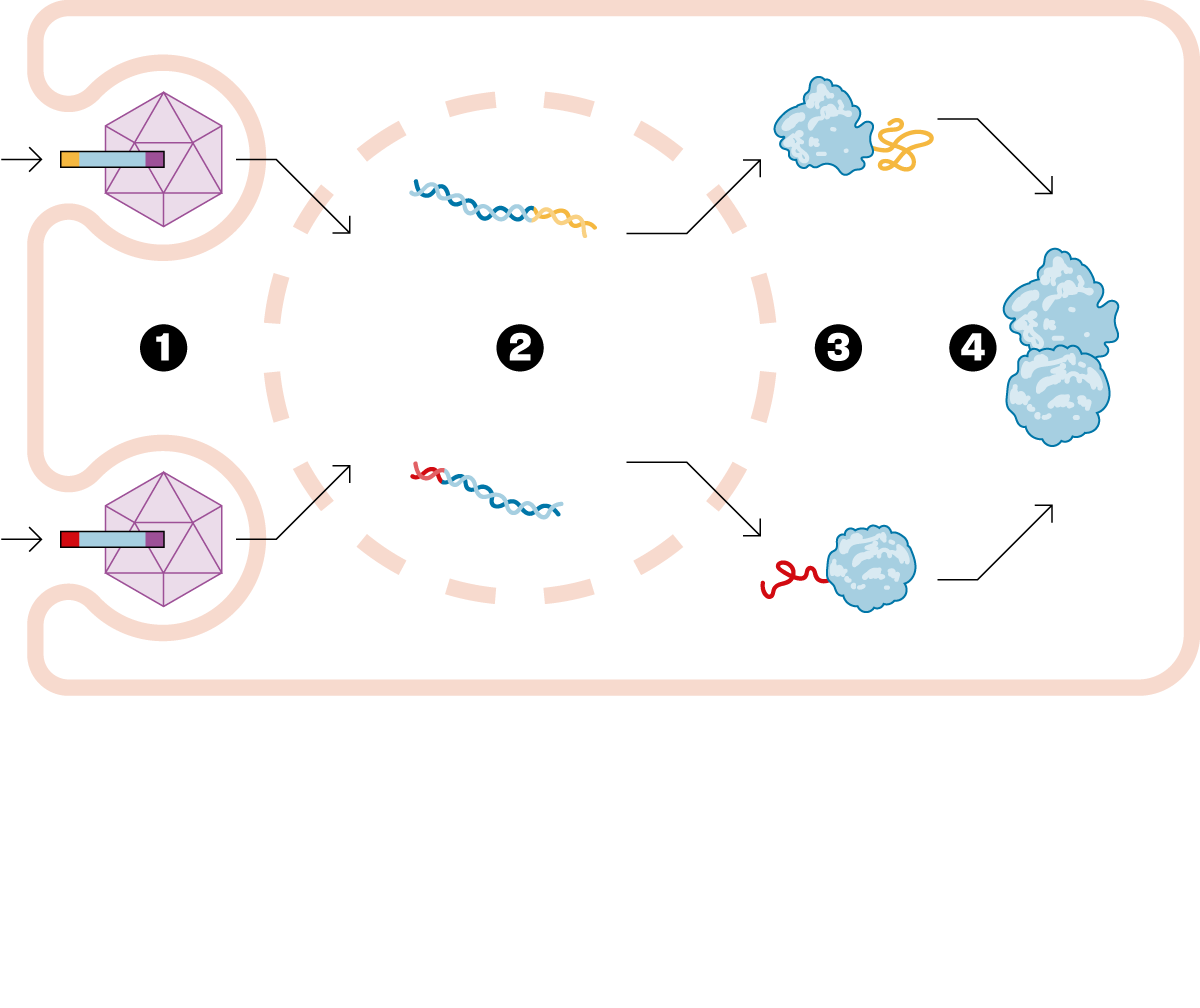
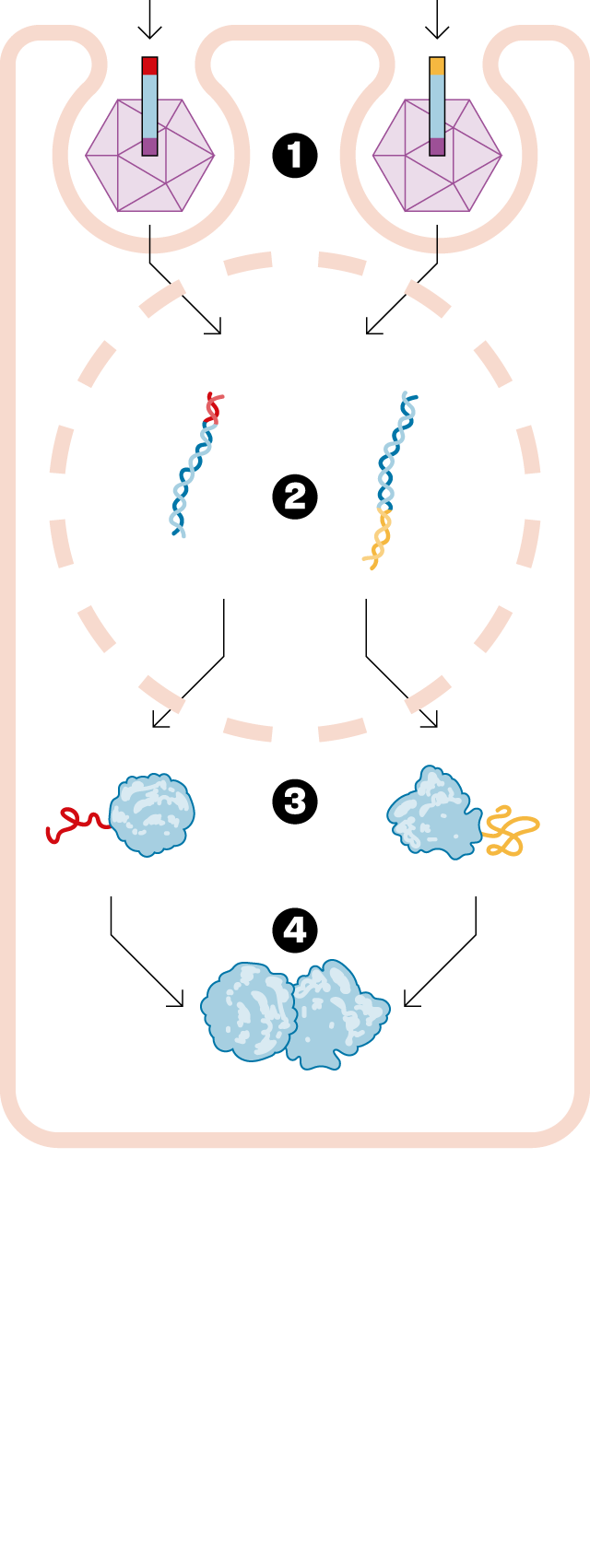
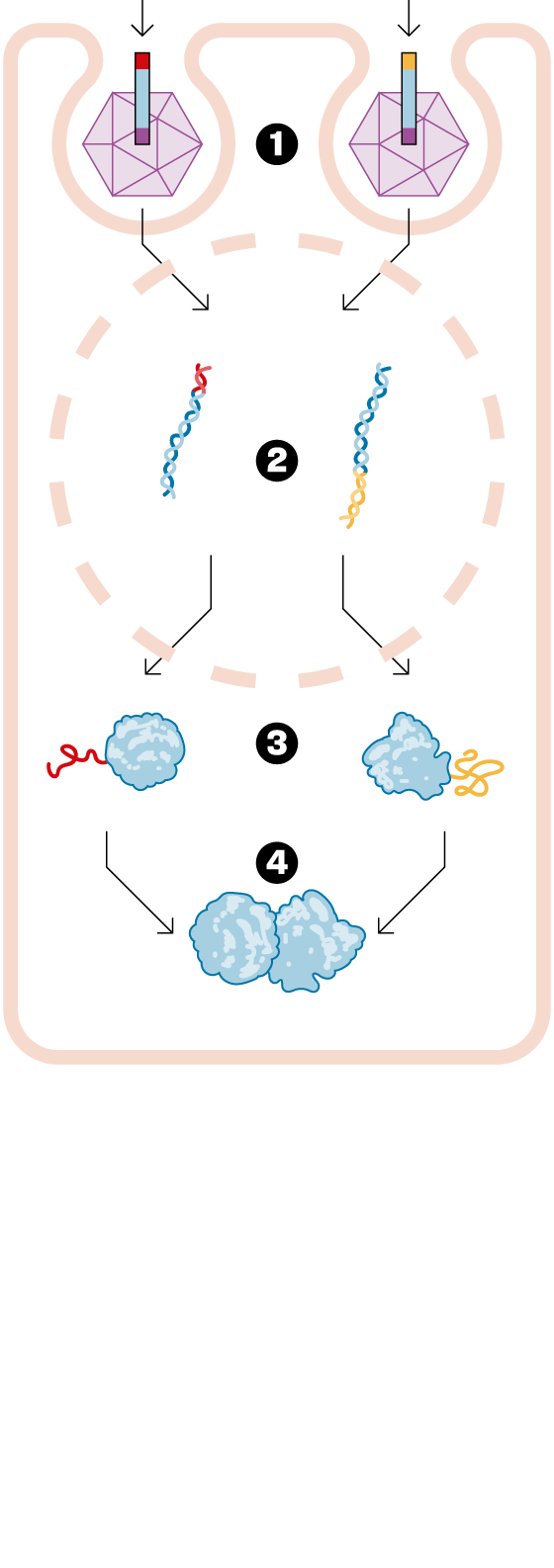
— Hi ha malalties que són causades perquè un gen té una mutació que provoca que no funcioni bé. Concretament, no fa la proteïna que hauria de fer, ja que els gens es dediquen a fabricar proteïnes. La teràpia gènica consisteix en dissenyar un fàrmac que entrega una versió bona d'aquest gen malalt i, així, cures la malaltia. Dels milers de fàrmacs que hi ha aprovats, només sis són una teràpia gènica. És un camp molt innovador. Fins ara, la teràpia gènica tradicional ha pogut injectar un gen petit. El que passa és que molts d'aquests gens a substituir són massa grossos. La tecnologia que vam desenvolupar a Princeton permet entregar aquest gen en dos fragments. Un cop lliurat al pacient, es forma la proteïna sencera que necessites per curar-lo. Hem obert un nou univers dins de la teràpia gènica, i ara ens podem plantejar tractar tota una sèrie de malalties que abans no es podien curar.
Com ho heu fet?
— Per afegir el gen bo a l'organisme s'utilitza un virus que s'ha buidat de la seva part dolenta. Però dins d'aquest virus només hi caben gens fins a una determinada mida. La nostra solució consisteix en partir el gen en dues parts i ficar cada trosset en un virus diferent. Això és el nostre fàrmac i, quan l'injectem, s'allibera cada tros de gen i s'enganxa per formar la proteïna sencera que es necessita. Aquesta tecnologia s'anomena, en anglès, protein splicing. D'aquí ve el nom de SpliceBio. Splicing es pot traduir com empalmar o enganxar. En el camp de la teràpia gènica és on realment aquesta tecnologia pot ser transformadora, i permet fer coses que no eren possibles de cap altra manera.
Com pot ser que un virus serveixi per curar una malaltia?
— Els virus que fem servir són un tipus molt concret, anomenats virus adenoassociats. Primer de tot, no es poden reproduir i, després, no són perillosos per a la salut humana. Simplement infecten la cèl·lula on s'injecten, entreguen el gen bo i es desfan. De fet, funcionen com una capsa on només hi ha el material genètic.
Heu decidit centrar-vos en malalties genètiques que afecten els ulls.
— L'oftalmologia permet fer una injecció localitzada del tractament, amb la qual cosa no has d'exposar la resta del cos a la teràpia, i això redueix els riscos del fàrmac. L'ull és un òrgan considerat immunoprivilegiat perquè està molt aïllat de la resta del cos. Ens estem centrant en la malaltia de Stargardt, que afecta la retina. Es manifesta entre la primera i la segona dècada de vida, i els pacients es tornen progressivament cecs. És hereditària i no té cap tractament. És una malaltia minoritària, però, dins d'això, afecta un gran nombre de pacients, al votant de 100.000 entre Europa i els Estats Units, i actualment no hi ha cap tractament per a aquesta malaltia.
En quina fase es troba el fàrmac?
— L'objectiu de la ronda que acabem de tancar és finançar l'assaig clínic per a la malaltia Stargardt. El tractament del primer pacient el vam anunciar a principis d'aquest any. Hem començat als Estats Units i al Regne Unit, i treballem per portar-lo a algun país europeu. Ho hem decidit així per les dificultats reguladores a Europa. Als Estats Units, quan sol·licites l'autorització a l'agència reguladora de medicaments FDA, de cop i volta tens accés a 350 milions de pacients. A Europa, en canvi, cal demanar autorització a cada país. En el nostre cas, amb una malaltia minoritària, no en tens prou amb un únic país, i això t'obliga a anar a múltiples països, cosa que complica molt el procés.